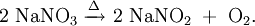1. Alice Aubert, JLU GI: Nitrate Cycle Role Playing Game
Nitrate Cycle Role Playing Game
Chemischer Zustand der Grundwasser-Vorräte in Deutschland
Ca. 27 % aller Grundwasser-Vorräte in Deutschland sind aufgrund hoher Nitratgehalte in einem schlechten chemischen Zustand (www.hlug.de 2014)
Das Projekt Studienlandschaft Schwingbachtal
wurde 2009 von der Justus-Liebig-Universität Gießen eingerichtet. Es hat zum Ziel, interaktive Lehre in der Natur zu ermöglichen und Landschaft aus verschiedenen Blickwinkeln zu betrachten. Unterstützt wird es von der Gemeinde Hüttenberg.
- Tafeln des Rundweges
- Übersichtskarte der installierten Messinstrumente
- Handbuch über die Geräte und Methoden
http://www.uni-giessen.de/cms/fbz/fb09/institute/ilr/studienlandschaft/startseite/allgemeines
Nitrat-Chemie, Gewässer und Gesundheit
Nitrate sind die Salze und Ester der Salpetersäure (HNO3). Die Salze haben die allgemeine Zusammensetzung MINO3 (MI: einwertiges Kation). Einige der Salze werden mit dem historischen Trivialnamen Salpeter bezeichnet. Das Anion NO3- trägt eine negative Ladung.
Der Einbau des Stickstoffs in die organischen Verbindungen der Pflanzen, d.h. die Stickstoff-Assimilation, erfolgt in Form von NH4+ Ionen. Die Pflanze muss die aufgenommenen Nitrat-Anionen (NO3-) daher reduzieren zu NH4+ Kationen.
Leitfähigkeits-Messgerät zur Bestimmung des Salzgehaltes des Bachwassers
(Handbuch S. 28)
Die elektrische Leitfähigkeit einer Lösung wird durch gelöste, also bewegliche und hydratisierte Ionen ermöglicht. Somit ist die elektrische Leitfähigkeit ein Indikator für gelöste Ionen (Solute) im Wasser, unter anderem für Nitrat-Ionen (N03-). Dabei nimmt der elektrische Widerstand [Ohm] der Lösung mit zunehmender Solutkonzentration ab, während der reziproke Leitfähigkeitswert [Siemens] zunimmt. Wie auch der pH-Wert zählt die elektrische Leitfähigkeit zu den Indikatoren, mit denen die chemische Gewässergüte gemessen werden kann.
Bildung und Abbau von Nitraten
Im Boden und in Gewässern werden Nitrate durch bakterielle Nitrifikation gebildet.
Dabei werden zunächst organische, stickstoffhaltige Verbindungen über die Ammonifikation zu Ammoniak (NH3) umgewandelt. In Wasser gelöst, wird das stechend riechende Ammoniak Gas zu Ammonium (NH4+). Die Oxidation des Ammoniums durch Bakterien der Gattung Nitrosomonas führt zur Bildung von Nitrit (NO2-), das sodann durch Bakterien der Gattung Nitrobakter zu Nitrat (NO3-) oxidiert wird. Über mehrere mikrobielle Zwischenschritte entsteht aus Nitrat bei vollständiger Denitrifikation unter Sauerstoffausschluss elementarer gasförmiger Stickstoff (N2).
Nitrate als Stickstoffquelle für Pflanzen
Pflanzen benötigen Stickstoff, unter anderem, um verschiedene Proteine daraus herzustellen. Doch nur sehr wenige Pflanzen können mit Hilfe symbiontischer Bakterien den elementaren Luft-Stickstoff N2 direkt aufnehmen.
Ammonium-Ionen und Nitrat-Ionen hingegen werden von allen pflanzlichen Organismen als Stickstoffquelle direkt genutzt und verwertet. Sie werden daher in der Landwirtschaft als Düngemittel eingesetzt. Dabei wird unterschieden zwischen anorganischen (künstlichen) Mineraldüngern und organischen Düngern (Gülle, Stallmist, auch als Wirtschaftsdünger bezeichnet).
Dünger enthalten Stickstoff zum Teil als Nitrat (z.B. Calciumnitrat in Blaukorn-Dünger) und zum Teil als Ammonium-Verbindungen (Ammonium-Nitrat, Ammonium-Phosphat). In organischen Düngern finden sich zudem auch organische Stickstoff-Verbindungen (Proteine, Amine, Harnstoff). Der organisch gebundene Stickstoff wird im Boden entweder zu Nitrat mineralisiert (s.o.) und im Bodenwasser gelöst, oder er bleibt in der organischen Substanz gebunden und geht in den Bodenhumusvorrat ein. Aus dem Bodenhumus kann er langfristig wieder mineralisiert werden (i.d.R. 1 bis 3% Mineralisierungsrate pro Jahr).
Umweltwirkungen
Nitrateintrag in Böden und Gewässer kann zur Eutrophierung (Nährstoff-Überschuss) führen. Besonders bei Gewässern mit geringer Fließgeschwindigkeit kann im Zusammenwirken mit Phosphor-Verbindungen ein vermehrtes Wachstum von Algen und Cyanobakterien die Folge sein. Bei übermäßigem Eintrag von Nitrat in Böden und Gewässer verschiebt sich der Nährstoffhaushalt nährstoffarmer (oligotropher) Standorte zugunsten nährstoffreicher (eutropher) Bedingungen.
Sowohl bei der Nitrifikation als auch bei der Denitrifikation können Spurengase wie N2O (Lachgas) oder NO entweichen. Lachgas ist ein klimarelevantes Spurengas und an der Entstehung des Treibhauseffektes beteiligt. NO spielt in der Atmosphären-Chemie eine wichtige Rolle und ist unter anderem an der Bildung und dem Abbau von bodennahem Ozon beteiligt.
Gesundheitliche Bedeutung des Nitrats
Eine Folge der Überdüngung kann ein Anstieg des Nitratgehaltes im Grund- und Trinkwasser sein. Der aktuelle Grenzwert für NO3− im Trinkwasser liegt laut der deutschen Trinkwasserverordnung bei 50 mg/l (50 ppm = 50 parts per 1 million parts = 50 mg per 1000 g), nach der schweizerischen Gewässerschutz-Verordnung bei 25 mg/l (25 ppm, siehe unten). Rohwasser, das diese Grenzwerte überschreitet, muss von Wasserversorgern, z.B. den Stadtwerken, mit nitratärmerem Wasser vermischt werden, um den Grenzwert für Trinkwasser einzuhalten.
Die Ursache für gesundheitliche Risiken liegt in der Gefahr einer Reduktion des Nitrats im Trinkwasser zu gesundsheitsschädlichem Nitrit.
Nitrat wird besonders bei Säuglingen im Magen zu Nitrit reduziert. Nitrit oxidiert den roten Blutfarbstoff Hämoglobin, der Sauerstoff zu den Körperzellen transportiert, zu Methämoglobin: Nitrit oxidiert im Hämoglobin Fe2+ zu Fe3+, so dass Methämoglobin entsteht. Methämoglobin kann selbst keinen Sauerstoff transportieren, und es hindert das Hämoglobin daran. Zu viel Nitrat im Trinkwasser führt somit zu einer Sauerstoff-Unterversorgung der Körperzellen (Anämische Anoxie), besonders bei Säuglingen. Eine Nitrat-Vergiftung geht einher mit Verwirrtheit, Bewusstseinsstörungen, Übelkeit, bei hoher Nitrit- bzw. Methämoglobin-Konzentration führt sie zum Tod.
Auch bei Wiederkäuern besteht durch Nitratreduktion im Pansen eine akute Gefahr der Vergiftung durch Nitritbildung. Kondenswasser in Ställen kann 8.000 bis 10.000 ppm Nitrat (aus Ammoniak) enthalten. Wasser mit 200 bis 500 ppm kann für Rinder und Schafe toxisch sein. Tägliche Dosen von 150 mg K-Nitrat pro kg führen nach drei bis 13 Dosen zum Abort (Fehlgeburt).
Des Weiteren können aus Nitrit Krebs erregende Nitrosaminen entstehehen. Im Darm siedeln Bakterien, die diese Reaktion durchführen können. Auch durch sehr hohe Temperaturen beim Braten oder Grillen gepökelter Fleisch- und Wurstwaren entstehen Nitrosamine aus Nitrit, das als Pökelsalz verwendet wird.
So reagiert zum Bespeil Natriumnitrat unter Sauerstoffabspaltung zu Natriumnitrit:
Nitrat als Problemstoff für Gewässer
Bei überdosiertem Einsatz von stickstoffhaltigen Düngern in der Landwirtschaft und bei unangepasster Bodenbewirtschaftung gelangt Nitrat in die Gewässer. Nitrat gelangt entweder durch Düngung mit Hof- oder Mineraldünger in den Boden oder es entsteht durch bakterielle Abbauprozesse von organischem Material im Boden (siehe oben). Nitrat ist sehr gut wasserlöslich. Das im Boden vorhandene Nitrat kann von den Pflanzen oft nicht vollständig aufgenommen werden. Somit wird ein Teil des Nitrats durch die Niederschläge aus dem Boden in das Grundwasser ausgewaschen oder in Fließgewässer abgeschwemmt.
Auswaschung von Nitrat in das Grundwasser
Ein gut durchwurzelter und bepflanzter Boden hält das Nitrat im Boden und in den Planzen zurück. Unter Wald, aber auch unter Grasland, ist die Nitratauswaschung deshalb geringer als unter Ackerland. Ebenso wichtig wie die Bodenbedeckung ist der Zeitpunkt der Düngung. Wird Dünger im Herbst kurz vor der Vegetationsruhe ausgebracht, im Winter oder im Frühling vor Vegetationsbeginn, ist die Auswaschungsgefahr am größten, denn der Nitratbedarf der Pflanzen ist in der dunklen, kalten Jahreszeit gering. Erhöhte Nitratgehalte im Wasser sind die Folge einer nicht standortgerechten landwirtschaftlichen Bodennutzung. (www.bafu.admin.ch)
Nitrat als Leitsubstanz
Nitrat im Grundwasser weist oft auf das gleichzeitige Vorhandensein anderer Stoffe im Grundwasser hin, wie z. B. auf Pflanzenschutzmittel oder auf Rückstände von Tiermedikamenten aus der Gülle (www.bafu.admin.ch). Der Nachweis von Nitrat ist dabei relative einfach und preiswert im Vergleich zu den sehr teuren Nachweisverfahren für Pflanzenschutzmittel und Tiermedikamenten im Grundwasser.
Auch Klarschlämm aus Kläranlagen, als Dünger auf die Äcker ausgebracht, kann neben großen Mengen an Nitrat und Ammonium auch Medikamenten-Rückstände enthalten, die so über die Toiletten auf dem Acker landen und in das Grundwasser gelangen können. Die große Zahl verschiedensten Chemikalien und deren Metabolite im Wasser nachzuweisen, ist nur sehr kostenaufwändig oder aber gar nicht möglich. Das gleiche gilt für die Entfernung gefährlicher, potentiell gefährlicher oder bezüglich ihrer Wechselwirkungen noch unerforschter Chemikalien aus dem Wasser. Wechselwirkungen von Chemikalien-Cocktails im Boden sowie in Pflanzen und Tieren sind bisher kaum erforscht.
Anforderungen und Toleranzwerte für Nitrat
Unbelastetes Grundwasser weist einen Nitratgehalt von unter 10 mg/l auf. In Gebieten mit intensiver landwirtschaftlicher Nutzung sind die Werte dagegen deutlich höher.
Besonders Gebiete mit einem hohen Anteil an Ackerfläche weisen im Grundwasser oft Nitratwerte von mehr als 25 mg/l, mehr als 50 mg/l, teilweise sogar mehrere Hundert mg/l auf.
Eine Nitratkonzentration von 25 mg/l ist die Toleranzgrenze gemäss Anhang 2 Gewässerschutzverordnung GSchV der Schweiz. 40 mg/l ist die Trinkwasser-Toleranzgrenze der Fremd- und Inhaltsstoff-Verordnung der Schweiz. Nach der deutschen Trinkwasserverordnung liegt der Grenzwert für Nitrat im Trinkwasser bei 50 mg/l (50 mg per 1000 g = 50 parts per 1 million parts = 50 ppm).
Rohwasser, das die - je nach Land unterschiedlichen - Grenzwerte überschreitet, muss von Wasserversorgern, zum Beispiel den Stadtwerken, mit nitratärmerem Wasser vermischt werden, um den Grenzwert für Trinkwasser einzuhalten. Dies wird mit zunehmender Nitrat-Kontamination der Rohwässer zunehmend schwieriger und kostenaufwändiger.
Quellen:
- http://www.bafu.admin.ch/gewaesserschutz/01308/01313/01314/?lang=de
- http://www.hlug.de/fileadmin/dokumente/wasser/hydrogeologie/Fortbildungs-_und_Vortragsveranstaltungen/Grundwassertag2014/Nitrat_im_Grundwasser_Wolter.pdf
- http://www.chemie.de/lexikon/Nitrate.html#Bildung_und_Abbau_von_Nitraten
- http://www.chemie.de/lexikon/Assimilation_%28Biologie%29.html#Nitrat-Assimilation
- http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/5/bc/vlus/pflanzenernaehrung.vlu/Page/vsc/de/ch/5/bc/pflgent/pflanzenernaehrung/stoffkreislauf/stickstofffixierung/stickstofffixierung.vscml.html
- http://www.rinderskript.net/skripten/b10-4.html
- http://Wikipedia.de